

L’infezione del tratto urinario (UTI) rappresenta oggi una delle più diffuse patologie, colpendo ogni anno 150 milioni di persone in tutto il mondo (Ozturk & Murt, 2020) e rappresentando un costo altissimo da un punto di vista economico e sociale. Si stima che il 40% delle donne adulte sviluppi almeno una UTI durante la vita e più dell’11% ne abbia almeno un episodio all’anno; questa percentuale aumenta nelle donne in menopausa (Terlizzi et at. 2017).
Le donne sono più colpite rispetto agli uomini probabilmente a causa di differenze ormonali e anatomiche. Infatti, l’uretra femminile, essendo un canale più breve, facilita il transito dei batteri dall’apertura uretrale alla vescica. Inoltre, la distanza ridotta tra ano e vagina può facilitare la colonizzazione dell’introito vaginale da parte di patogeni gastrointestinali. Oltre a fattori di genere, i principali elementi di rischio per l’insorgenza di UTI sono rappresentati da età, stato di gravidanza, utilizzo di cateteri, incontinenza e immunosoppressione (Guglietta 2017).
Nello specifico, il termine UTI indica un’infiltrazione microbiotica del tratto urinario sterile e si riferisce alla presenza di specifici microorganismi nelle urine (in genere >105 CFU/ml) (Terlizzi et al. 2017). Clinicamente, cistiti acute o UTI senza complicazioni sono definite come infezione del tratto urinario sintomatiche e isolate, mentre UTI ricorrenti (rUTI) indicano 2 infezioni senza complicazioni in un lasso di tempo di sei mesi o 3 infezioni nell’arco di un anno. Sebbene le UTI ricorrenti non siano in genere letali, gli effetti negativi o comunque spiacevoli sono diversi, tra cui l’aumento significativo delle spese mediche e in generale una peggiore qualità della vita.
L’uropatogeno Escherichia coli (UPEC) è il batterio più comune e causa l’80-90% dei casi di UTI, seguito da Klebsiella pneumoniae, Entorococcus faecalis e Staphylococcus saprophyticus (Bedenic & Mestrovic 2021).
I batteri uropatogeni utilizzano le fimbrie (strutture presenti sulla superficie batterica ed utilizzate dai microorganismi per aderite ai siti bersaglio) per aderire e colonizzare l’epitelio dell’uretra e della vescica, con una conseguente penetrazione nel tessuto. Oltre all’infezione, il batterio può innescare una risposta infiammatoria e un’infiltrazione di neutrofili, che possono proliferare, formare biofilm, produrre batterio-tossine e proteasi con conseguente danneggiamento dell’epitelio (Flores-Mireles et al. 2015). Se tale condizione non viene trattata in tempo, a seguito delle iniziali fasi tali batteri possono migrare nel rene e causare una grave patologia conosciuta come pielonefrite (Bedenic & Mestrovic 2021).

La terapia principale prevede l’utilizzo di tre antibiotici come, ad esempio, il trimetoprim – sulfametossazolo, Nitrofurantoina e fosfomicina (American Urological Association, AUA, guidelines – 2019). D’altro canto, però, un uso ripetitivo di antibiotici è associato all’insorgere di patogeni multi-farmaco resistenti e alla disbiosi del microbiota (intestino e vagina) (Jones-Freeman et al. 2021).
Quando è possibile, i medici prediligono quindi approcci alternativi, che possono essere valide opzioni per ridurre il crescente rischio di effetti collaterali. Le più comuni misure non antibiotiche includono mirtilli rossi, D-mannosio, probiotici, immunostimolanti ed estrogeni (Shira et al. 2018).
La prevenzione proattiva e la cura della propria igiene intima, che stanno aumentando tra la popolazione, rimangono in ogni caso i migliori alleati per evitare l’insorgere di queste patologie.

In questo contesto, l’IHS (International Health Science) ha sviluppato un nuovo integratore per le vie urinarie non farmaceutico – denominato DAPAD – con lo scopo di aggirare il problema della resistenza agli antibiotici, ottenere un’azione multi-target sia sull’UPEC che su altri batteri, valorizzare il sistema immunitario innato, rispettare il microbioma e prevenire la formazione di biofilm da parte di batteri patogeni.
L’efficacia di DAPAD è stata validata attraverso 2 studi preclinici (De Seta et al. 2020; De Seta et al. 2022) e un trial clinico randomizzato, in doppio cieco, controllato con placebo.
Il primo studio in vitro (De Seta et al. 2020) è consistito in un’osservazione dell’attività antimicrobica di un gruppo di possibili componenti dell’integratore per le vie urinarie – analizzate da sole o in combinazione – contro agenti patogeni urinari e organismi probiotici. Il fine era quello di selezionare il mix di ingredienti ottimale e più efficace. Un ulteriore obiettivo dello studio era quello di osservare la formazione di biofilm e l’attività immunitaria di questi nelle cellule epiteliali della vescica infetta. I risultati hanno mostrato che molte delle sostanze testate svolgevano un’attività antimicrobica contro gli uropatogeni e altri supportavano i microrganismi probiotici, causando anche una moderata modulazione dell’attività infiammatoria. Sulla base di questi risultati, è stata selezionata una formulazione formata dalle proprietà più benefiche di tutti i composti, poi valutata attraverso un secondo pre-test in vitro. Quest’ultimo aveva lo scopo di dimostrare i meccanismi d’azione di DAPAD, sottolineando l’attività di ogni componente come, ad esempio, prevenire la colonizzazione da parte dei batteri, modulare la risposta infiammatoria, esercitare una funzione antimicrobica e favorire la proliferazione di probiotici e microbiota sani.
L’indagine clinica è stata svolta su 70 donne a cui era stata diagnosticata una UTI senza complicazioni in base alla coltura delle urine (E. coli > 105 CFU/ml). Ognuna di esse ha assunto due bustine al giorno (mattina e sera) di DAPAD o placebo, sciolte in un bicchiere di acqua (150 ml), per 5 giorni consecutivi. Le donne sono state visitate prima dell’inizio del trial (giorno 0), alla fine del trattamento (giorno 5) e un mese dopo il trattamento (giorno 35). I sintomi sono stati valutati durante ogni visita e sono stati raccolti campioni di urina per la coltura al giorno zero e alla fine del trattamento. Il risultato prevalente è stata la risoluzione clinica alla fine del trattamento e al follow up. I principali risultati secondari sono stati invece il sollievo e la risoluzione batteriologica alla fine della terapia, definite come eliminazione dell’infezione E. coli ceppo senza recidiva di batteriuria (<105 CFU/mL).
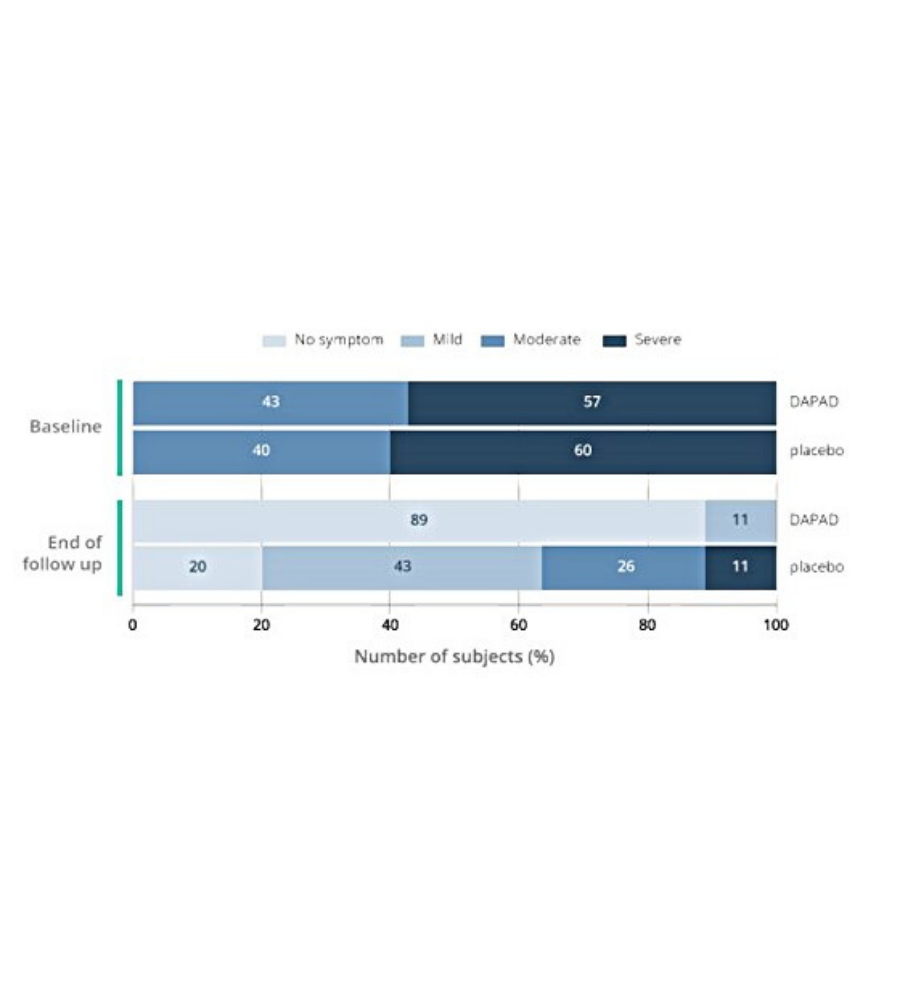
Le risultanze dello studio hanno mostrato che, dopo 5 giorni di trattamento con DAPAD, il 34% delle donne non presentava i sintomi a differenza del gruppo placebo, dove nessuno degli individui osservati ha manifestato benefici apprezzabili.
Figura 1. Studio per sviluppo di un integratore per le vie urinarie: gravità dei sintomi di UTI nei soggetti trattati con DAPAD o placebo in condizione basale e alla fine del periodo di follow up (giorno 35). p<0.0001 DAPAD vs Placebo al giorno 35.
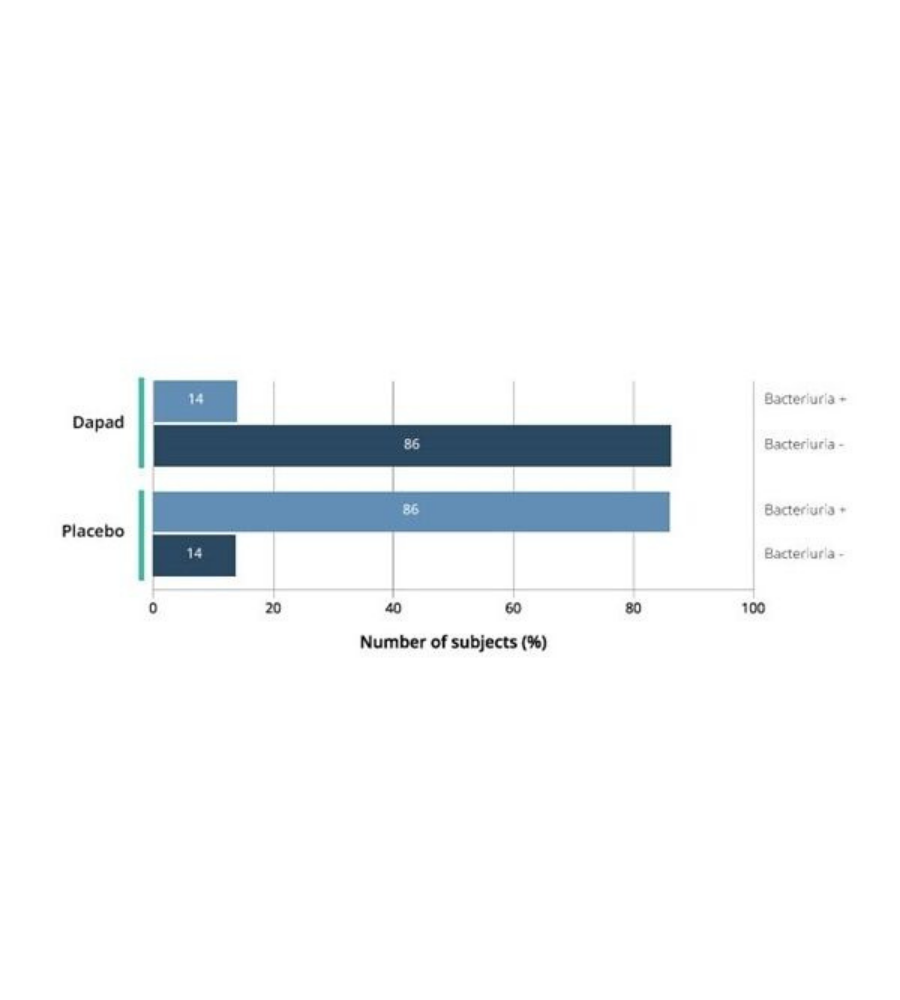
Le risultanze dello studio hanno mostrato che, dopo 5 giorni di trattamento con DAPAD, il 34% delle donne non presentava i sintomi a differenza del gruppo placebo, dove nessuno degli individui osservati ha manifestato benefici apprezzabili.
Figura 1. Studio per sviluppo di un integratore per le vie urinarie: gravità dei sintomi di UTI nei soggetti trattati con DAPAD o placebo in condizione basale e alla fine del periodo di follow up (giorno 35). p<0.0001 DAPAD vs Placebo al giorno 35.
Bedenić, B., Meštrović, T. Mechanisms of resistance in Gram-negative urinary pathogens: from country-specific molecular insights to global clinical relevance. Diagnostics (Basel). 2021;11(5):800.
De Seta, F. et al. Preclinical evaluation of pharmaceutical compositions and their components for urinary health. Open J Obstet Gynecol. 2020; 10:151-165.
De Seta, F. et al. Rational development and evaluation of novel formulations for urinary health. Eur J Obstet Gynecol Reprod Biol. 2022; 269:90-97.
Flores-Mireles, A.L. et al. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nat Rev Microbiol. 2015;13(5):269-84.
Guglietta, A. Recurrent urinary tract infections in women: risk factors, etiology, pathogenesis and prophylaxis. Future Microbiol. 2017; 12:239-246.
Jones-Freeman, B. et al. The microbiome and host mucosal interactions in urinary tract diseases. Mucosal Immunol. 2021; 14:779–792.
Öztürk, R. & Murt, A. Epidemiology of urological infections: a global burden. World J Urol. 2020; 38(11):2669-2679.
Shira, N. et al. Nonantibiotic prevention and management of recurrent urinary tract infection. Nat Rev Urol. 2018;15(12):750-776.
Terlizzi, M.E. UroPathogenic Escherichia Coli (UPEC) infections: virulence factors, bladder responses, antibiotic, and bon-antibiotic antimicrobial strategies. Frontiers in Microbiol. 2017; 8:1566.
